Корро́зия или ржавление — это самопроизвольное разрушение поверхностей металлов и сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой.
Этим коррозия отличается от разрушения по физическим причинам: эрозии, истирания, износа.
На неметаллические материалы определение коррозии не распространяется. Так, для резин и полимеров существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия. Однако говорить «коррозия резины» не совсем верно: механизмы и кинетика процессов для неметаллов и металлов будут разными.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление» — коррозия железа и его сплавов с образованием продуктов коррозии, состоящих из гидратированных остатков железа.
Пример — кислородная коррозия железа в воде:
Образовавший в результате гидроксид железа и называется ржавчиной.
Мы все видели ржавчину, но на всякий случай несколько примеров:
Ржавый мост первой четверти прошлого века

Фрагмент металлической ограды. Видно, как слезает слой эмали, и на незащищённых участках возникает ржавчина.

Рельса со следами ржавчины

Крепёжный элемент со следами глубокой коррозии, заметна даже деформация поверхности

Классификация коррозии
Процессы коррозии отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому единой классификации до сих пор нет.
Коррозию можно различать по:
- механизму протекания: химическая и электрохимическая;
- условиям протекания коррозионного процесса: контактная коррозия, коррозия при погружении — неполном, полном или переменном, коррозия при трении, коррозия под напряжением;
- типу агрессивных сред, в которых протекает процесс разрушения: газовая, атмосферная, подземная, коррозия в электролитах/неэлектролитах;
- характеру (масштабу) разрушения: сплошная или локальная коррозия, равномерная или неравномерная, точечная, сквозная и т.д.
Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Наиболее частая форма коррозии — электрохимическая. Это разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов.
Гальванический элемент возникает, когда электроды — два металла с различными окислительно-восстановительными потенциалами — погружаются в раствор электролита (конденсат, дождевая или морская вода и т. д.). А если если в воде (например, в морской) растворены ионы солей, кислот, или т. д., её электропроводность повышается, она является более мощным электролитом, поэтому скорость процесса коррозии увеличивается.
В гальваническом элементе происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. При этом, если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется.
На этом основана, например, защита железных изделий от коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать с образованием на своей поверхности оксидной плёнки. Плёнка существенно замедляет процесс коррозии. Но о защите о коррозии мы поговорим позднее.
Химическая коррозия это взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисления металла и восстановление окислительного компонента коррозионной среды протекают в одном акте.
Как бороться с коррозией
Коррозия приводит ежегодно к миллиардным убыткам. Мы говорим о прямых (стоимость разрушившейся конструкции, стоимость замены оборудования) и косвенных убытках (простои оборудования при необходимом и плановом ремонте, утечка продуктов, нарушение технологических процессов).
Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в стоимости изделий, разрушаемых коррозией.
Согласно международным стандартам (ISO 8501-1) и российским ГОСТам, защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения.
Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата является абразивоструйная очистка.
Традиционно выделяют три направления методов защиты от коррозии:
- Конструкционный: использование нержавеющих сталей, цветных металлов. Также при проектировании инженеры стараются изолировать материалы от среды с помощью герметиков, резиновых прокладок и т.д.
- Активный: изменение структуры двойного электрического слоя, например, с помощью катодной защиты — наложения постоянного электрического тока
- Пассивный: нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента. Это может быть лакокрасочное покрытие, полимерное покрытие, эмаль, тонкий слой других металлов (цинк, олово, хром, никель, кадмий)
Ржавчина как вид коррозии
Продукты коррозии железа и его сплавов (сталь) называют ржавчиной. Как правило, это образования оксида железа, но подобный же процесс происходит при взаимодействии железа и хрома. При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. В солёной воде это происходит намного быстрее (см. выше). Ржавчина является проницаемой для воздуха и воды, поэтому проржавевший слой не защищает более нижние слои железа.
Ржавчина разделяется по цветам, и это не случайно.
Красные и оранжевые оттенки образуются под воздействием кислорода на железо под воздействием воды.
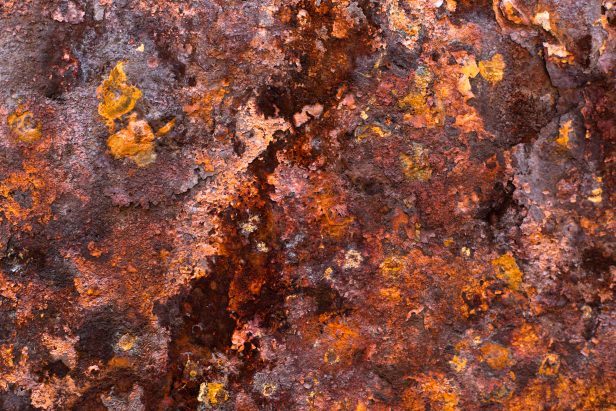
Зелёная ржавчина встречается реже. Она образуется под воздействием на железо хлора без участия в процессе кислорода.

Защита от ржавчины аналогична защите от коррозии в целом. Это:
- покрытие цинком, оловом, хромом или кадмием различными методами (гальванизацией, напылением, осаждением и т.д.);
- катодная защита — подача на металл постоянного электрического заряда;
- искусственное снижение влажности среды;
- различные антикоррозийные ингибиторы.
Дополнительные материалы:
http://www.corrosioncost.com — англоязычный сайт об экономических последствиях коррозии.
Ржавление в домашних условиях
Выше мы говорили в основном о природном ржавлении. Однако существует несколько достаточно простых способов ускорить появление ржавчины в домашних условиях.
Первым шагом станет поиск подходящего металла. Ржавлению подвержены металлы с содержанием железа, но как мы уже знаем, часть из них эффективна защищена от коррозии. Однако ржавлению хорошо поддаются чёрные металлы, чугун, кованное железо. Для эксперимента хорошо подойду гвозди (неоцинкованные) и другая не защищённая от коррозии металлическая фурнитура. Обычно такую фурнитуру используют для внутренних работ, в помещениях с нормальной влажностью.
Выбранный материал перед искусственным ржавлением нужно обработать — на нём наверняка остались грязь или — особенно в случае с гвоздями — машинное масло. Достаточно вымыть металлическое изделие с мылом, а затем прокипятить в обычной кастрюле 10 минут, а затем остудить.
Второй шаг — подготовка коррозирующей среды. Это может быть:
- обычная водопроводная вода;
- фильтрованная вода;
- вода с добавлением соли;
- вода с добавлением соды;
- вода с добавлением уксуса.
Добавление соли, соды и уксуса создает среду разной кислотности, с разным уровнем ph.
Третий шаг это, собственно, сам процесс заржавления.
Вы помещаете подготовленный металл в коррозирующую среду. Скорость протекания процесса ржавления и масштаб разрушения металла зависит от продолжительности, температуры (в холоде или при жаре процесс пойдёт по-разному).
ВАЖНО! Выберите для работы хорошо проветриваемое помещение, используйте перчатки и пластиковую посуду (но не одноразовую — она может не выдержать).
Можно поэкспериментировать и приготовить более «экзотическую» коррозирующую смесь.
Ржавление с помощью перекиси водорода и поваренной соли
- Перекись водорода
- Поваренная соль
Необходимо сначала обработать поверхность металла перекисью водорода (просто погрузив в ёмкость или с помощью пульверизатора), затем нанести сверху некрупную соль.
Металл начнет ржаветь достаточно быстро, а интенсивность процесса зависит от количества соли. После внесения соли дайте металлу высохнуть на свежем воздухе, а потом убирайте остатки соли. Этот метод интересен тем, что можно создавать на металле узоры и надписи, нанося перекись водорода на определённые участки металла.
Ржавление с помощью перекиси водорода и уксуса
- Перекись водорода
- Уксус
Необходимо сначала обработать поверхность металла перекисью водорода: в этот раз удобнее использовать пульверизатор. Затем, не дав перекиси высохнуть, аналогичным образом нанести уксус.
При нормальной температуре воздуха эффект ржавления проявится через несколько часов.
Ржавление с помощью лимонного сока и соли
- Лимон
- Поваренная соль
Здесь необходимо приготовить именно смесь. Возьмите лимонный сок и соль в отношении 4 к 1, и нанесите на металл.
Есть и другие способы ускорить ржавление (с помощью различных бытовых чистящих средств, растворителей, отбеливателей и т.д.). Но их использование может быть опасно.
Дополнительная сведения о ржавлении металлов:
К вопросу «Откуда на гвоздях машинное масло?»
http://metalgeek.com/archives/2006/06/13/000065.php — ресурс на английском языке
UPD!
Осталось чуть больше месяца до завершения нашей конкурсной программы, и нам — как авторам — было бы интересно получить обратную связь. Она поможет в дальнейшем сделать наши программы ещё более интересными и увлекательными. Пожалуйста, заполните анкету по ссылке, это не отнимет у вас много времени.






